JFE-TEC News
No.60「元素不純物分析(ICH Q3Dガイドライン)」
JFE-TEC News No.60号 医薬分析 特集号 記事一覧

全文 PDF (2.5 MB)
No.60 医薬分析 特集号
元素不純物分析(ICH Q3Dガイドライン)~日本薬局方JP17第二追補に収載日本薬局方に従って元素不純物の評価が始まります~
Elemental Impurities Test (ICH Guideline Q3D) was Listed in the Japanese Pharmacopoeia
医薬品の安全性がますます重要になる中で、医薬品中の不純物の厳しい管理が求められています。不純物とは、医薬品有効成分または製剤に残存している不要な化合物です。医薬品の品質、有効性、安全性に関するガイドラインを作成している日米EU医薬品規制調和国際会議(ICH)では、不純物の管理についても議論を重ね、不純物に関するガイドライン(ICH Q3)を公開しています。
当社では、製剤や原薬中の不純物や異物の分析、容器由来の不純物の評価、さらには有効成分の確認試験によって、品質管理、許認可申請、技術開発をトータルサポートしています。その技術のいくつかをご紹介いたします。
なぜいまこれが?
医薬品の元素不純物試験がいよいよ本格的に始まります。2019年6月28日、第十七改正日本薬局方第二追補の一般試験法に「元素不純物試験法」が、参考情報に「製剤中の元素不純物の管理」が収載され、日本薬局方に従った元素不純物の評価・管理となりました。
これまでの重金属試験は、限定された種類の元素の総量を鉛として求める方法で、元素不純物の評価としては不十分でした。2015年9月に、医薬品の元素不純物ガイドライン(ICH Q3D)が日本でも発出され、元素の毒性や混入リスクに応じた24元素の許容一日曝露量(PDE)が決定されました。医薬品中の元素濃度をPDE値と比較する個別評価が始まったことで、元素不純物試験は測定感度の高い誘導結合プラズマ質量分析法(ICP-MS)による評価に移行しています。
これがポイント!
当社では、2016年からクリーンルームに設置したICP-MSによりGMPならびに信頼性基準で元素不純物分析を受託してきました(図1・図2)。日本薬局方に試験法が収載されるまでは、米国薬局方の元素不純物試験法を用いて、金属・半導体・有機材料など様々な分野で培った極微量元素分析技術を応用して、正確かつ精度よい分析を提供してきました。もちろん、第二追補に収載された元素不純物試験法での実績もあります。

図1 クリーンルーム外観 
図2 誘導結合プラズマ質量分析装置(ICP-MS)
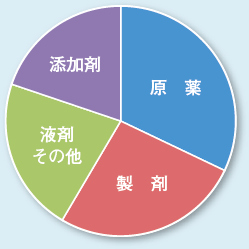
これまでに、100を超える医薬品や医薬品を構成する物質の元素不純物を評価してきました。その評価対象物質を図3に示します。製剤には、原薬に加えて多種類の賦形剤や安定剤などの添加剤が混合されています。元素不純物試験では、鉱物由来の賦形剤が容易には分解しない場合があることから、賦形剤の完全な分解は試験実施のポイントとなります。当社は、材料分析における試料の完全分解技術を適用することで、数多くの賦形剤や賦形剤を含む製剤中の元素不純物を正確に評価してきました。また、μg、ngレベルの分析が必要になるPDE値との比較評価においても、材料分析における極微量元素分析技術が役に立っています。
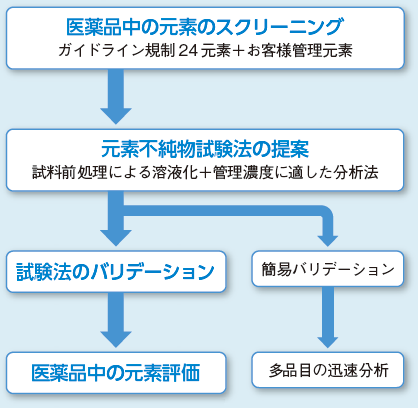
いずれの物質の元素不純物の評価においても、お客様の評価目的や管理基準に応じて、医薬品の金属不純物のスクリーニング、試料の分解法ならびに分析法の確立、確立した分析法のバリデーション、限度試験または定量試験を提供しております。元素不純物評価の流れの一例を図4に示します。薬局方に収載された試験法にもとづいた分析においても、対象物質の性状や評価する元素濃度によって、試料の溶液化方法やICP-MSでの分析条件が異なることがあります。当社では、お客様のご要望やご質問に対応し、これまで培った技術力で高感度、高精度の元素不純物評価結果を提供しています。
お気軽にご相談ください。
関連リンク・関連記事
このページに関する
お問い合わせはこちらから
- JFEテクノリサーチ株式会社 営業総括部
- 0120-643-777


