医療機器・インプラント材料評価
医療用注射針・注射筒の溶出試験
ページ内メニュー
医療用注射針・注射筒からの溶出試験を実施します。
溶出試験の概要
医用材料・医療機器は、構成する元素や製造過程で使用され残留する化学物質などリスクアセスメントの根拠となるデータの収集が推奨されており、当社ではこれら化学的情報収集のための試験を行っています。
例えば、医療用注射針や注射筒では、日本産業規格(JIS)の化学的要求事項として溶出金属の制限の項目が設けられており、量が規定されています。
対応規格例
| 日本産業規格(JIS)番号 | 規格名 | 試験項目 |
|---|---|---|
| JIS T 3209 | 滅菌済み注射針 | 溶出試験(Pb,Sn,Zn,Fe, Cd) |
| JIS T 3210 | 滅菌済み注射筒 | |
| JIS T 3253 | インスリン皮下投与用注射筒 | |
| JIS T 3254 | 血液ガス検体採取用注射筒 |
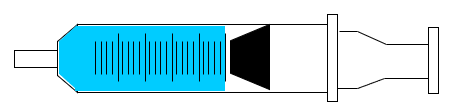
溶出試験の例(JIS T 3210 滅菌済み注射筒)
溶出操作
注射筒を公称目盛の位置まで精製水(日本薬局方の医薬品各条に規定する水)で満たし、気泡を排除します。その注射筒を37℃、8時間保持した後の精製水を溶出試験液とします。
溶出条件はご希望に応じて変更可能です。ご依頼の際にお問い合わせください。
溶出元素分析
溶出試験液中の元素を各種分析装置*1を用いて分析します。
溶出条件、分析対象元素により報告下限値が異なりますので、ご依頼の際にお問い合わせください。
*1 分析装置の例
-

ICP質量分析装置(ICP-MS)
-

ICP発光分光分析装置(ICP-AES)
-

電気加熱原子吸光分析装置(ET-AAS)
信頼性基準対応
計画書、試験記録、報告書など申請用の資料作成も行っております。詳細はお問い合わせ時にご相談ください。
作業の流れ

関連リンク・関連記事
- 医療用注射針・注射筒の溶出試験 [事例集PDF]
- 微量分析(化学・医療関連分析)
- 医療・医薬品の成分分析
このページに関する
お問い合わせはこちらから
- JFEテクノリサーチ株式会社 営業総括部
- 0120-643-777


